细胞周期
通过细胞周期,实现细胞生长、细胞分裂前DNA复制以及细胞分裂。
细胞周期的演进具有高度精确性,包括细胞周期事件发生的严格时序性、遗传物质复制的精确性以及分配的均等性等。
一、细胞周期的概念
地球上所有生物,从单细胞到哺乳动物,均是通过重复的细胞生长和分裂而维持生存和保持物种延续的。一个细胞经过一系列生化事件,复制其组分,然后一分为二,形成两个子细胞,这种周而复始的循环连续过程,即为细胞周期(cell cycle)。通常,我们将从一次细胞分裂结束开始,经过物质准备,到下一次细胞分裂结束为止,称为一个细胞周期。
细胞周期具有高度精确的特性,首先必须实现细胞分裂前遗传物质的精确复制,进而通过细胞分裂确保子细胞遗传物质的精确分配。细胞周期可分为有丝分裂期(mitosis)和分裂间期(interphase)两个基本的部分。其中,有丝分裂期又称为M期,而分裂间期则分为G1期、S期和G2期。绝大多数真核细胞,细胞周期严格按照“间期(G1-S-G2)-M-间期”的规律连续循环。
细胞分裂期(M期)与DNA复制合成时期(S期)是整个细胞周期的两大关键环节,G1和G2期最主要的任务就是通过合成大量特定蛋白质,储存能量及其他物质,细胞体积增大,促进细胞生长,分别为DNA复制和细胞分裂做好准备(图13-8)。
同种细胞之间,细胞周期长短基本相同,但在机体的不同发育阶段和不同种类的细胞中细胞周期持续时间差别很大,例如芽殖酵母的细胞周期仅90分钟,受精卵早期的细胞周期可能短于30分钟。
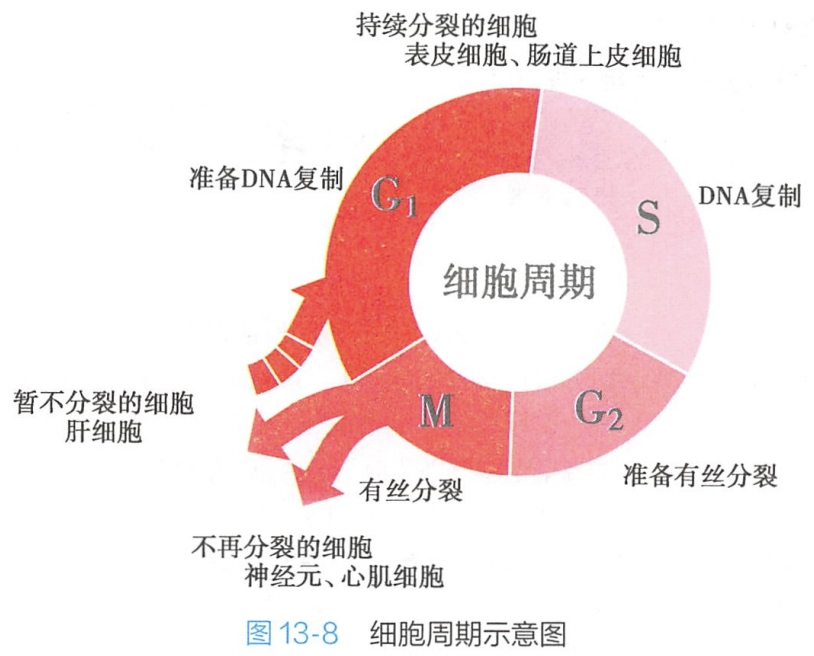
M期持续时间很短,而间期占据了细胞周期的95%以上的时间。就高等生物而言,细胞周期的长短主要取决于G1期长短,而S期、G2期与M期时间总体恒定。典型的快速增殖的人体细胞的细胞周期时间大约24小时,其中G1期约11小时, S期约8小时,G2期4小时,M期1小时,因此,间期中的G1期,是影响细胞周期时间的关键。G1期的时间长度与G1期细胞中的某些特殊的 mRNA及蛋白质的积累相关。此外,激素、生长因子等环境因素也能影响细胞周期长短,如环境温度高于39℃或低于36℃,细胞周期各时相的时间将随之按比例地变化。
依据细胞增殖及细胞周期特性,可将多细胞生物中的细胞群体分为三类:
- 周期细胞(cycling cell):这类细胞持续分裂、增殖,细胞周期持续循环,如上皮组织的基底层细胞。
- 终末分化细胞:一类分化程度高的细胞,待其分化成熟,将不再分裂,细胞周期因此终止,包括神经元、大量横纹肌细胞、红细胞等。
- G0期细胞,又称静止细胞(quiescent cell):这类细胞暂时性终止细胞周期,停止细胞分裂,但是一旦需要,G0期细胞可快速返回正常细胞周期,实施分裂增殖,如在一般情况下处于不分裂的静息“休眠”状态的皮肤成纤维细胞和肝实质细胞,在需要替换损伤或死亡的细胞时可迅速出现分裂增殖。
二、细胞周期各期的主要特征
(一)G1期是DNA复制的准备期
G1期细胞围绕两大主要活动:细胞生长;为细胞进入S期做准备。
G1期是经典细胞周期进入增殖分裂期循环中的第一期,在推动整个细胞周期演进中发挥重要的始发作用。G1期起始依赖于细胞外生长和分裂的信号刺激,如相关生长因子,随着G1期演进,当物质合成与准备足够充足,将通过G1晚期阶段的一个特定时相位点,这个位点在酵母中称为起始点(starter),在哺乳动物细胞称为限制点(restriction point,R点)。G1期细胞一旦通过此点,将启动细胞 G期向S期演进。G1细胞如果通过此限制点,将不受生长因子控制,即使在缺少生长因子的条件下,细胞仍然会进入S期,进而完成后续细胞分裂增殖。
G1期细胞的主要特征为细胞体积增大,细胞体积与质量都比上一次分裂结束时约增加一倍,同时呈现极为活跃的物质代谢特点。
1.大量RNA和蛋白质合成
合成S期DNA复制起始与延伸所需的酶类,如DNA聚合酶,也包括G1期向S期转换过程中起重要作用的一些蛋白质,如:触发蛋白、钙调蛋白、细胞周期蛋白、抑素等。
2.蛋白质磷酸化
细胞中发生了多种蛋白质的磷酸化,如组蛋白、非组蛋白及某些蛋白激酶的磷酸化。促进G1晚期染色体结构发生改变,有利于S期DNA合成。
3.细胞膜物质转运加强
细胞对氨基酸、核苷酸、葡萄糖等小分子营养物质摄入量增加,保证了 G1期中进行的大量生化合成有充足的原料。此外,细胞对一些可能参与G1期向S期转变的调控物质的转运也增加,cAMP含量在G1早期增加迅速,K+可因Na+-K+ATP酶活性在G1期发生短暂的升高而大量流入细胞。
(二)S期中完成DNA复制
S期是细胞周期进程中非常重要的一个阶段,此期细胞主要的特征是DNA复制,合成组蛋白及非组蛋白等染色质蛋白,新合成DNA到染色质结构的组装。
细胞由G1期进入S期时,DNA合成所需的酶类,如DNA聚合酶、DNA连接酶、胸腺嘧啶核苷激酶、核苷酸还原酶等含量或活性显著增高。
DNA复制遵循严格的时间顺序。通常,早复制的多为GC含量较高的DNA序列,而晚复制的DNA序列AT含量较高。常染色质的复制在先,异染色质复制在后,如女性失活的X染色体最后复制。
S期是组蛋白合成的主要时期,进入S期后,组蛋白mRNA水平可增加50倍,新合成的组蛋白迅速进入胞核,与已复制的DNA结合,组装成核小体,进而形成具有两条单体的染色体。S期组蛋白合成后进一步发生磷酸化、乙酰化、甲基化等修饰,有助于基因转录和染色质凝集。
组蛋白的合成与DNA复制是同步进行、相互依存的。伴随着DNA的复制,胞质中组蛋白mRNA大量增加,当DNA复制在S期末完成,组蛋白mRNA也在短时间发生大量的降解。如果S期DNA复制被羟基脲、阿糖胞苷等物质抑制,细胞中组蛋白mRNA的水平也将发生并行性降低,组蛋白合成由此停止。反之,用环己亚胺、嘌呤霉素、吐根碱等抑制S期组蛋白质的合成,DNA的合成速率会迅速降低,进而在数秒钟内停止。
中心粒的复制开始于G1期,完成于S期。首先是相互垂直的一对中心粒彼此发生分离,然后各自在其垂直方向形成一个子中心粒,所形成的两对中心粒将作为微管组织中心,随着细胞周期进程的延续,在纺锤体微管、星体微管等的形成中发挥作用。
(三)G2期是细胞分裂的准备期
G2期细胞主要特点是为进入M期做准备,主要大量合成一些与M期结构和功能相关的蛋白质,如合成M期组装纺锤体必需的微管蛋白;对核膜破裂、染色体凝集有重要作用的细胞周期调控因子,如成熟促进因子等。在G2期,S期已复制的中心粒此时体积逐渐增大,开始分离并移向细胞两极。
(四)M期中细胞进行分裂
M期是细胞分裂期,细胞通过分裂将染色体遗传物质平均分配到两个子细胞,细胞在M期有丰富而显著的形态学变化规律与特点,包括染色体凝集后姐妹染色单体分离、核膜崩解与重建、纺锤体形成与消失,收缩环出现与胞质分裂等。
三、细胞周期的调控
细胞周期的演进具有高度精确性,包括细胞周期事件发生的严格时序性、遗传物质复制的精确性以及分配的均等性等。
细胞周期调控是一个精细复杂的过程,依赖于复杂的细胞周期调节蛋白网络,即细胞周期调控系统。细胞周期调控系统的基本构成在从酵母到人类的所有真核细胞中高度保守,其本质为一系列生化反应的有序发生。
同时,细胞周期调控系统能够对细胞内外信号产生应答,细胞外蛋白质或生长因子作用于细胞周期调控系统,可实现其对细胞周期的多因子、多层次调控。
(一)细胞周期蛋白与细胞周期蛋白依赖激酶构成细胞周期调控系统的核心
细胞周期蛋白(cyclin)为全酶的调节亚基,细胞周期蛋白依赖性激酶(cyclin-dependent kinase,Cdk)为催化亚基,不同cyclin选择性结合特定Cdk,两者结合后Cdk呈现激酶活性。
1.细胞周期蛋白
cyclin是真核细胞中的一类蛋白质,它们能随细胞周期进程周期性地出现(合成)及消失(降解)。cyclin通过选择性与Cdk结合,形成复合物,通过介导Cdk激活过程而参与细胞周期的调控。
真核生物的细胞周期蛋白是一些功能相似的同源蛋白,种类多达数十种,而哺乳动物的周期蛋白则包括cyclin A~H及cyclin T等九大类,而每大类则可包含多种蛋白,如存在三种具有组织及细胞特异性的cyclin D,即cyclin D1~3。
依据出现及发挥作用的细胞周期阶段,可以将细胞周期蛋白分为4类:
- G1期细胞周期蛋白: cyclin D;
- G1/S期细胞周期蛋白:cyelin E;
- S期细胞周期蛋白:cyclin A;
- M期细胞周期蛋白:cyclin B。
不同的cyclin在分子结构上存在共同的特点,即均含有一段氨基酸组成保守的细胞周期蛋白框(图13-9)。该保守序列含约100个氨基酸残基,可介导cyclin与Cdk结合而形成复合物,参与细胞周期的调控。
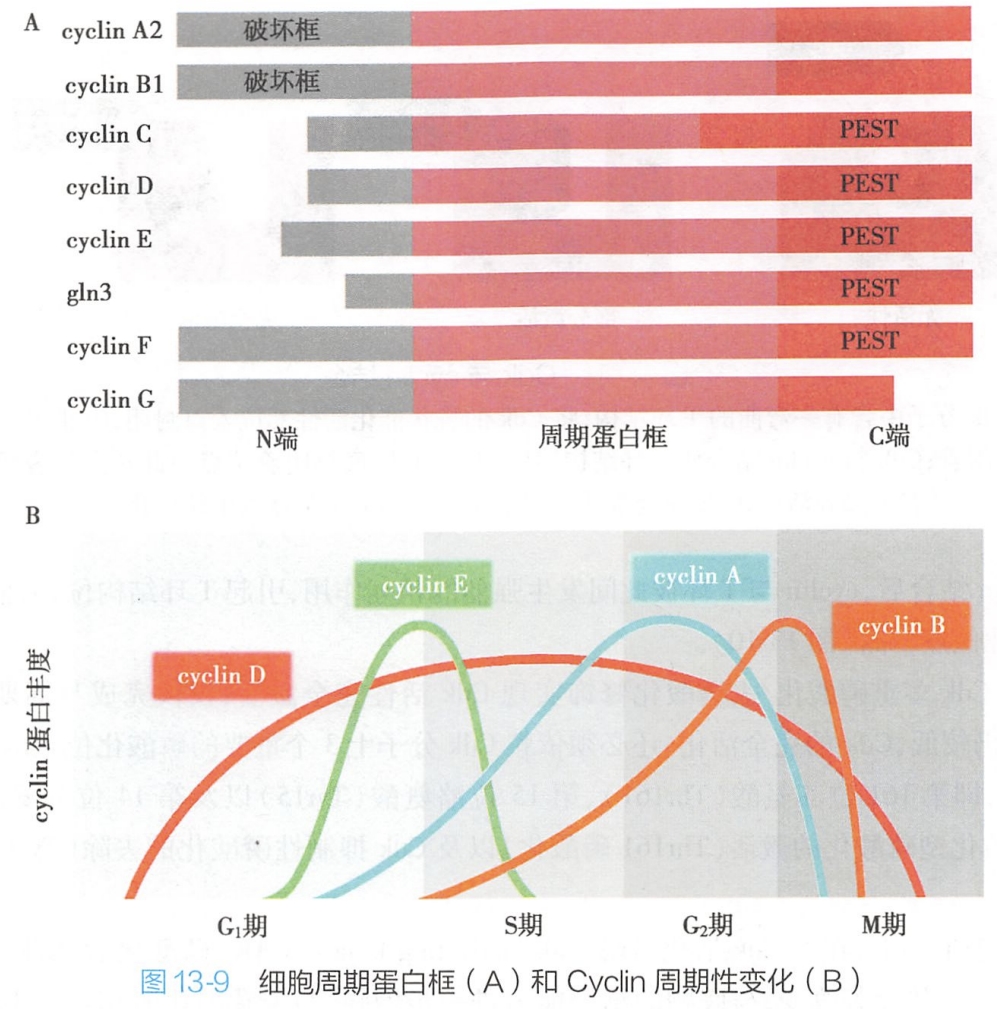
在S期及M期cyelin分子中还存在一段被称为破坏框的特殊序列,由9个氨基酸残基构成,位于蛋白质分子的近N端,可通过多聚泛素化-蛋白酶体途径介导cyclin A、B的快速降解。G1期周期蛋白虽然分子结构虽不具破坏框,但也可通过其C端的一段PEST序列的介导,发生降解。
2.细胞周期蛋白依赖性激酶
Cdk为一类必须与细胞周期蛋白结合后才具有激酶活性的蛋白激酶,通过磷酸化多种细胞周期相关蛋白,可在细胞周期调控中发挥关键核心作用。
现已被鉴定的Cdk为Cdk1~8。在不同的Cdk分子结构中,均存在一段相似的激酶结构域,其中有一小段序列具高保守性,是介导激酶与周期蛋白结合的区域。在细胞周期的各阶段,不同的Cdk通过结合特定的周期蛋白,使相应一系列的蛋白质磷酸化,由此引发或控制细胞周期的一些主要事件。
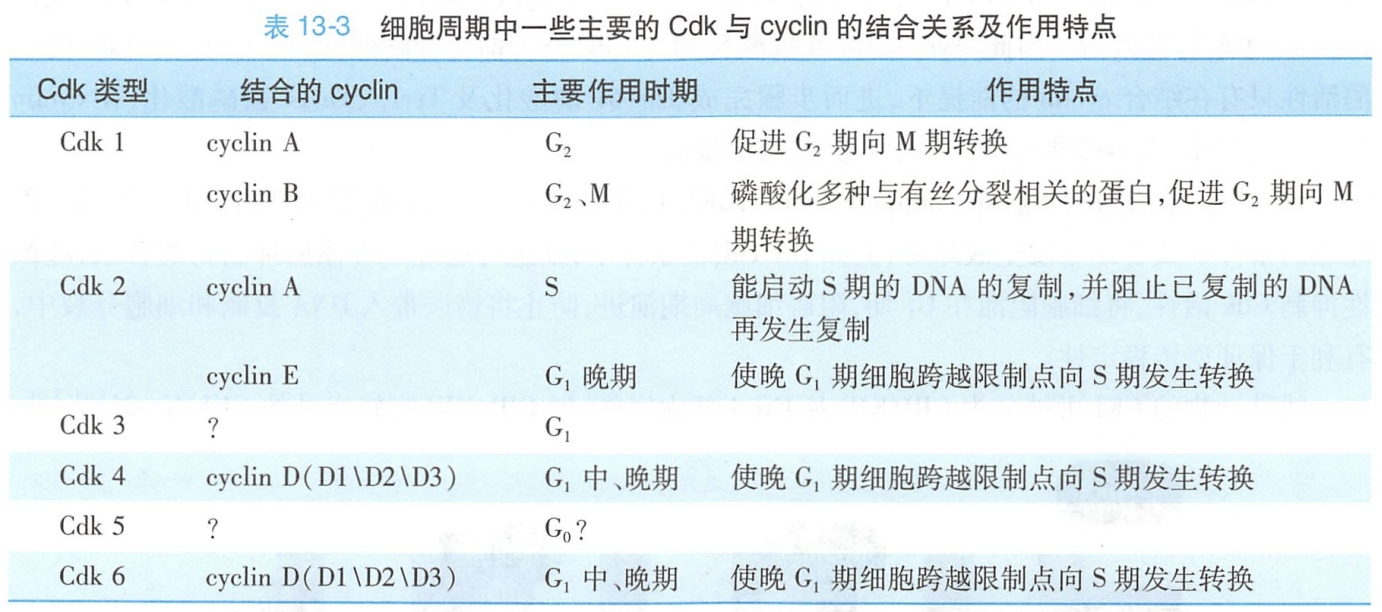
因细胞周期进程中cyclin可不断地被合成与降解,Cdk对蛋白质磷酸化的作用也因此呈现出周期性的变化(表13-3)。以Cdk为核心的细胞周期调控系统是细胞周期事件发生时序性和协调性的根本保证,因此Cdk的活性调节就是细胞周期调控的关键环节。为保证其精准性,细胞从多个层面正、反调控Cdk激酶活性,其中发挥主导作用的调控方式主要为:
- Cdk与特定cyclin结合;
- Cdk多重磷酸化/去磷酸化修饰;
- Cdk与Cdk抑制因子(CKI)结合。
(1)Cdk与周期蛋白结合是Cdk活化的基本条件:
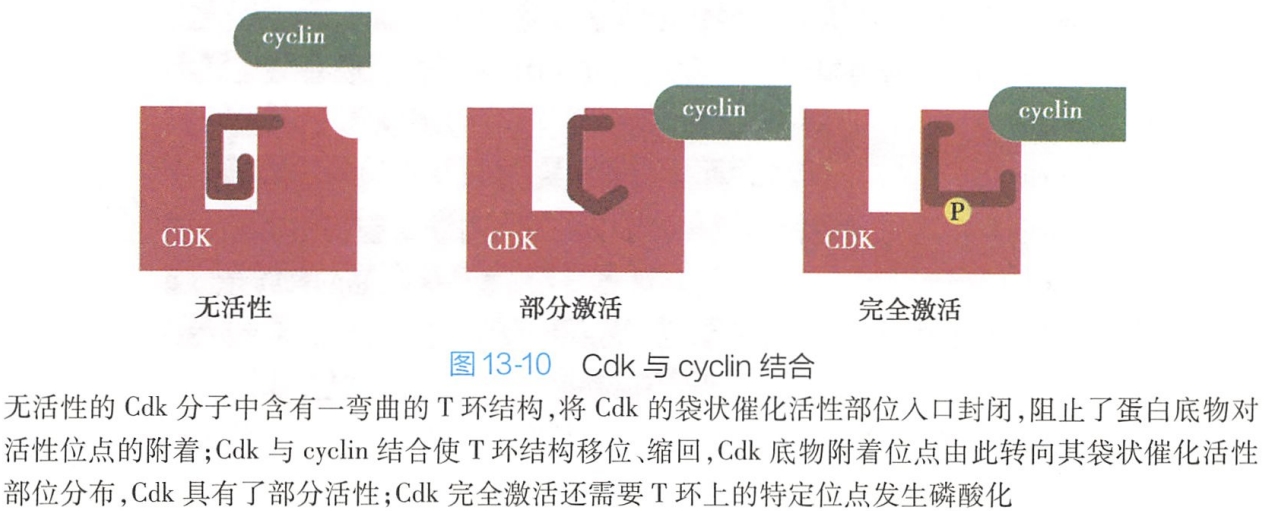
Cdk激活必须首先与细胞周期蛋白结合。周期蛋白与Cdk结合可通过改变Cdk空间构象,暴露出Cdk与底物结合的激酶催化活性位点,从而部分激活Cdk活性。
在裂殖酵母中,处于非磷酸化状态的无活性Cdk分子中含有一个弯曲的环状区域,称为T环,该结构将Cdk的催化活性部位入口封闭,阻止了蛋白底物与催化活性部位结合。当非磷酸化的Cdk与cyclin结合后,cyclin与T环彼此间发生强烈的相互作用,引起T环结构位移,催化活性部位入口打开,活性位点暴露(图13-10)。
(2)后续Cdk多重磷酸化/去磷酸化修饰实现Cdk活性完全激活:
仅仅完成与周期蛋白结合的 Cdk激酶活性仍较低,Cdk的完全活化,还必须依赖Cdk分子上3个重要的磷酸化位点的多重磷酸化/去磷酸化修饰,即第161位苏氨酸(Thr161)、第15位酪氨酸(Tyr15)以及第14位苏氨酸(Thr14)残基,即:
- Cdk活化型磷酸化的激活(Thr161磷酸化)。Thr161位于T环上,在经Cdk活化激酶(Cdk activating kinase,CAK)磷酸化后,Cdk-cyclin复合物上底物附着部位形状显著改变,与底物的结合能力进一步增强,因此,Thr161磷酸化被称为Cdk活化型磷酸化。
- Cdk抑制性磷酸化的去除(Tyr15、Thr14去磷酸化)。Tyr15、Thr14分布于Cdk与ATP结合部位,磷酸化的Tyr15、Thr14必须分别在Cdc25磷酸酶及myt激酶作用下发生进一步去磷酸化修饰,Cdk才最终被激活。因此,Tyr15、Thr14磷酸化称为Cdk分子抑制性磷酸化(图13-11)。
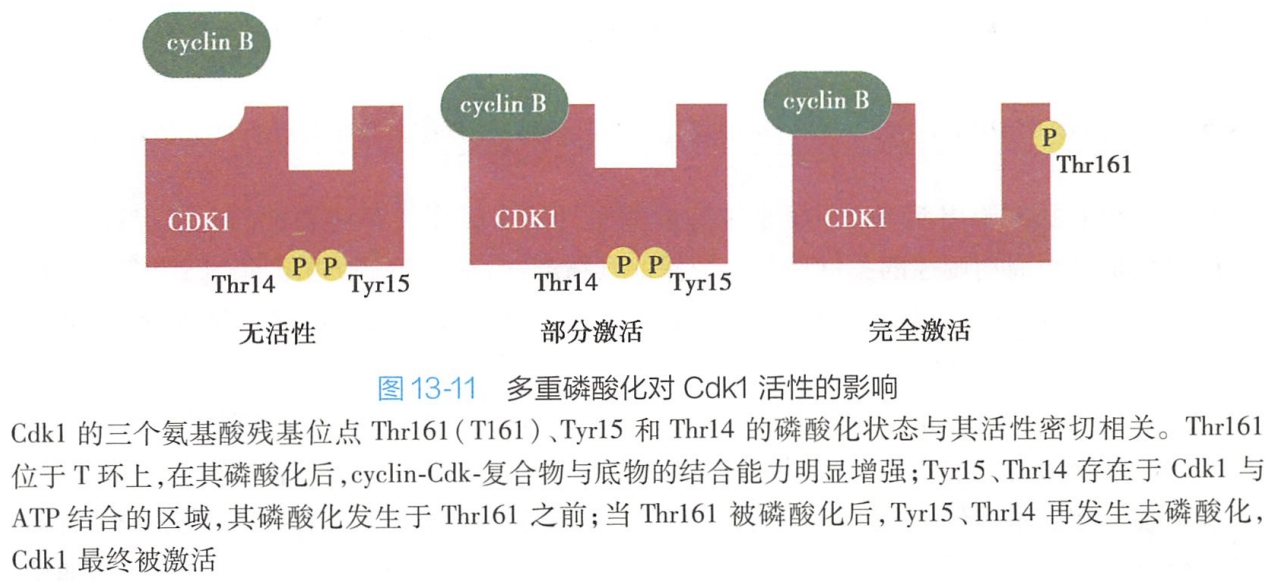
Cdk的激酶活性只有在结合cyclin的前提下,进而完成Thr161磷酸化及Tyr15、Thr14去磷酸化,即在结合cyclin及磷酸化/去磷酸化双重作用下才能被完全激活。
(3)Cdk激酶抑制物(Cdk inhibitor protein,CKI)的负性调节:
G1期Cdk受到严格控制。细胞在不理想的条件下或者细胞发生故障时,例如DNA损伤条件下,细胞可通过Cdk激酶抑制物的合成,应激性抑制Cdk活性,将细胞阻滞在G1期,阻碍细胞周期演进,防止将错误带入DNA复制和细胞分裂中。哺乳动物的CKI可被分为CIP/KIP及INK4两大家族:
- 属CIP/KIP家族成员的CKI有p21Cip1/Waf1、p27Kip1、p57Kip等,CIP/KIP家族p27Kip1,主要通过与cyclin B-Cdk2复合物结合,改变活性位点空间位置,从而抑制Cdk2活性。 #? 可能打错了是E吧
- INK4家族成员则包括p16INK4、p15INK4、p18INK4等。INK4两大家族则能通过特异性结合Cdk4和Cdk6,降低与底物结合的亲和力。
(二)cyclin-Cdk复合体对细胞周期的核心调控
cyclin-Cdk复合物是细胞周期调控体系的核心,直接掌控细胞周期各时相的有序运转。
- 作为驱动力,cyclin的周期性的表达及降解,将直接引发cyclin-Cdk复合物周期性的表达及降解,
- 导致不同Cdk分子激酶活性在特定时相的顺序激活,
- 由于不同Cdk激酶控制下的底物不同,而不同系列磷酸化修饰的底物将作为最终执行者,引发细胞周期进程中特定细胞事件的出现,并促成了G1期向S期、G2期向M期、中期向后期等关键过程不可逆的转换
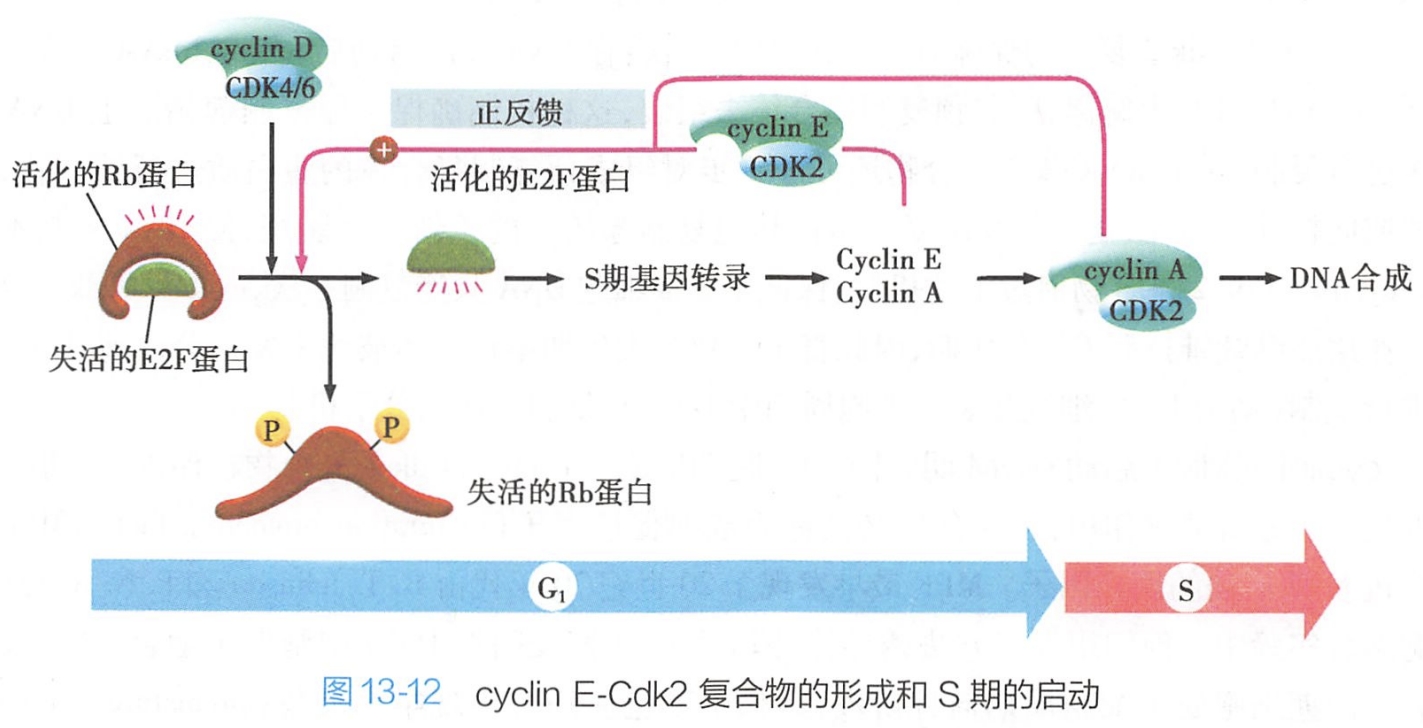
1.Cyclin D-Cdk4/6、Cyclin E-Cdk2复合物顺序启动G1/S期转化
G1期细胞在外界生长因子等促有丝分裂原刺激下,G1期细胞cyclin D表达增强,cyclin D-Cdk4/6复合物促进细胞生长,当cyclin D-Cdk4/6积累到一定程度时,活化的Cdk4/6通过磷酸化Rb蛋白,使其失活,释放与Rb蛋白结合而被抑制的转录因子E2F,E2F恢复活性,从而启动S期相关基因转录。抑癌基因包括Rb、p53、p21、p16。 #?
随着在G1晚期(G1/S期)cyclin E表达的上升,cyclin E-Cdk2复合体逐渐增多,活化的Cdk2则进一步激活E2F(正反馈)以及其他一些转录因子,与DNA复制相关基因的表达启动,从而使细胞跨过G1期限制点,产生DNA合成所需的酶与蛋白质,为细胞进入S期做准备(图13-12)。
2.cyclin A-Cdk2复合物保障S期的DNA复制
当细胞进入S期后,cyclin D/E-Cdk复合物中的cyelin D/E发生降解,cyclin A-Cdk2复合物形成。因cyclin D/E的降解是不可逆的,使得已进入S期的细胞将无法向G1期逆转。
cyclin A-Cdk2复合物是S期中最主要的cyclin-Cdk复合物,能启动DNA的复制,并阻止已复制的DNA再发生复制。
(1)cyclin A-Cdk2复合物启动DNA复制
与复制起点结合的蛋白质为一种大的多种蛋白质构成的复合体,称为起始点识别复合体(origin recognition complex,ORC),该复合体与复制起始点结合并作为许多其他调节蛋白的连接位点。
一种这样的调节蛋白是Cdc6,它在大多数的细胞周期中呈低水平表达,但在G1早期瞬间升高。在G1早期,Cdc6与复制起点的ORC结合,同时一组称为Mcm的解旋酶也与复制起点结合,结果在复制起点形成大的蛋白复合体,谓之预复制复合体(pre-rep lication complex)或前复制复合体。
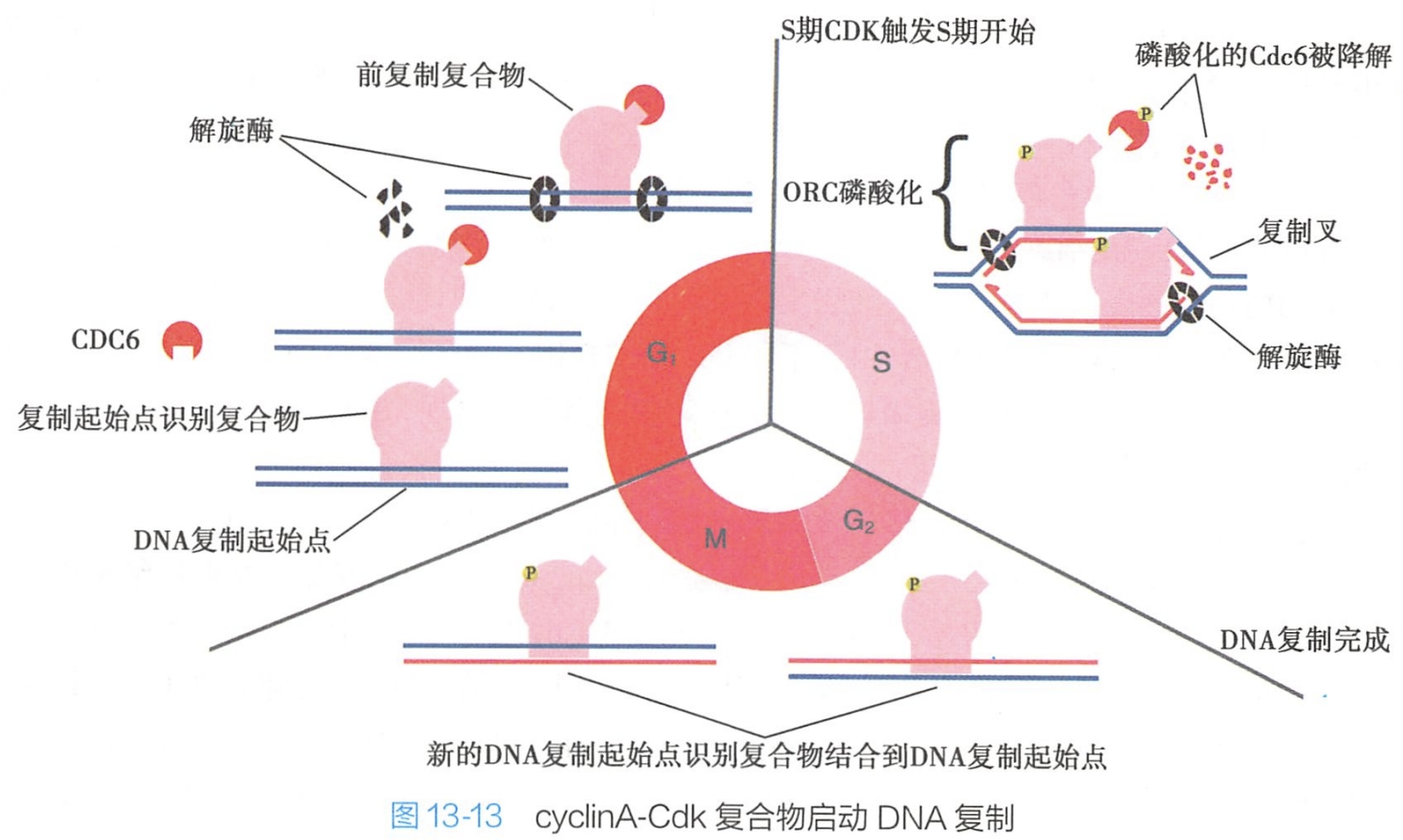
- cyclin A-Cdk2复合物利用其激酶活性可使与DNA复制起始相关的预复制复合体的某些位点发生磷酸化,预复制复合体由此被激活,DNA合成开始启动。
- 此外,cyclin A-Cdk2复合物还可通过磷酸化作用,激活预复制复合体中的某些DNA解旋酶的功能,通过解离DNA双链,促进与DNA合成相关的酶如DNA聚合酶等与单链DNA结合,启动DNA复制(图13-13)。
(2)cyclin A-Cdk2复合物保障DNA只能复制一次
- 在DNA复制启动后,在cyclin A-Cdk2复合物作用下,Cdc6从ORC上解离,引起预复制复合体去组装,这种机制确保在原复制起始点上DNA将不能再次进行复制。
- cyclin A-Cdk2复合物还可进一步对组成预复制复合体的蛋白质进行磷酸化,导致其降解或向核外转运,阻止了预复制复合体在其他复制起始点的重新聚合装配,使DNA复制不会再启动。
cyclin A-Cdk2复合物通过上述机制,保证了S期细胞DNA只能复制一次,cyclin A-Cdk2复合物的这一作用能继续维持到G2及M期,因此直至有丝分裂后期染色单体彼此未发生分离前,DNA均无法再进行复制。
3.cyclin B-Cdk1启动G2/M期转换
G2晚期形成的cyclin B-Cdk1复合物在促进G2期向M期转换的过程中起着关键作用,该复合物又被称为成熟促进因子(maturation promoting factor,MPF),意为能促进M期启动的调控因子。柱层析结果表明,MPF是由两种蛋白质亚基组成的异二聚体,即细胞周期蛋白依赖激酶Cdk1和cyclin B。在G2晚期,MPF活性发生显著升高。
4.M期中cyclin B-CdK1复合物的作用
M期细胞在形态结构上所发生的变化以及中期向后期、M期向下一个G1期的转换均与MPF相关。
(1)MPF促进染色体凝集
在细胞分裂的早、中期,MPF可通过磷酸化组蛋白H1上与有丝分裂有关的特殊位点诱导染色质凝集,启动有丝分裂。
MPF也可直接作用于染色体凝集蛋白,散在的DNA分子结合于磷酸化的凝集蛋白上后,沿其表面发生缠绕、聚集,介导了染色体形成超螺旋化结构,进而发生凝集。
(2)MPF促进核膜崩解
核纤层蛋白(lamin)也是MPF的催化底物之一,lamin经MPF作用后,其特定的丝氨酸残基可发生高度磷酸化,由此引起核纤层纤维结构解体,核膜破裂成小泡。
(3)MPF促进纺锤体的形成
MPF可对多种微管结合蛋白进行磷酸化,进而调控细胞周期中微管的动态变化,使微管发生重排,促进纺锤体的形成。
(4)MPF促进姐妹染色单体的分离
中期姐妹染色单体在着丝粒部位依靠粘连蛋白复合体(主要由Sccl和Smc组成)相连。在有丝分裂后期前,由于分离酶与分离酶抑制蛋白(securin)结合,分离酶呈现无活性状态,保障姐妹染色单体相连。
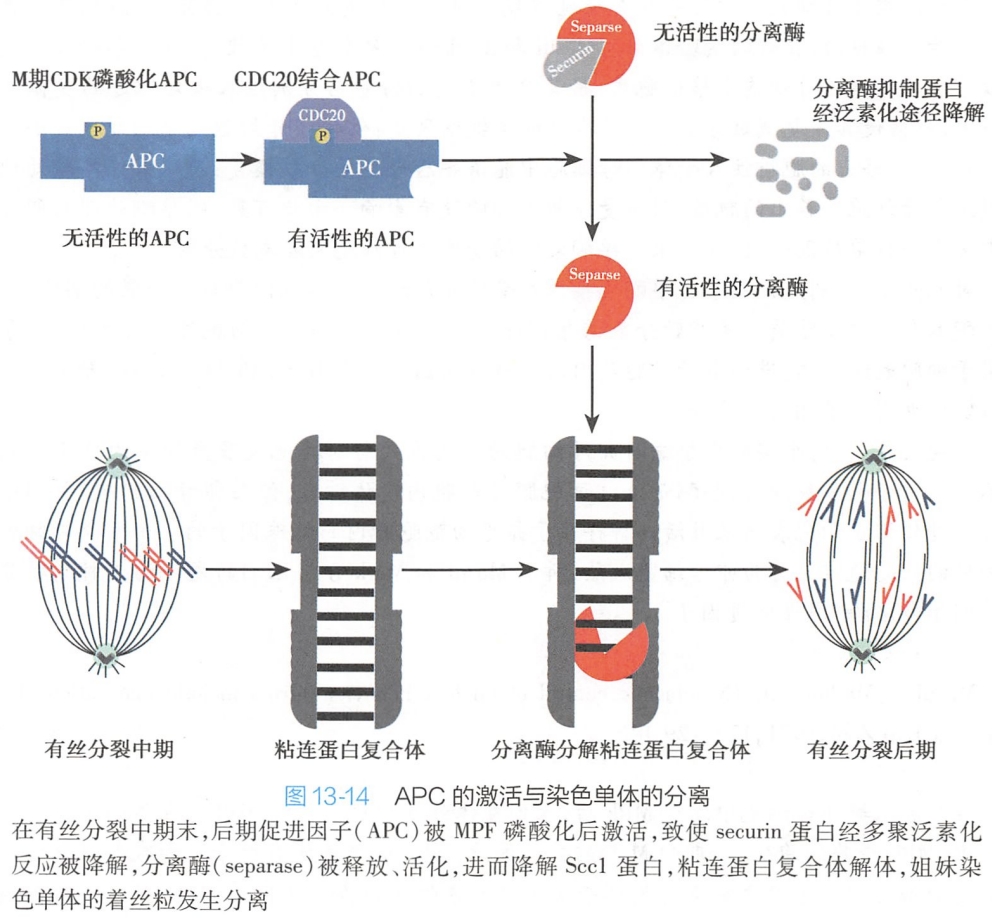
在中期较晚阶段,作为泛素连接酶之一的后期促进因子(anaphase-promoting complex,APC)可在MPF作用下开始发生磷酸化,进而与Cdc20结合而被激活,随后将引起分离酶抑制蛋白发生多聚泛素化反应,最终被降解,分离酶由此被释放、活化,在其作用下,姐妹染色单体之间的凝集力丧失而丝粒发生分离。粘连蛋白被分离酶(separase)分解而导致染色单体粘合力下降或消失,是姐妹染色单体分离的首要机制。在纺锤体微管的牵引下,分别移向两极,细胞进入后期阶段(图13-14)。
(5)MPF失活促进有丝分裂末期进程
随着有丝分裂后期进程,Cdc14磷酸酶活化,促使M期cyclin经多聚泛素化途径被降解,MPF解聚而失活,细胞转向末期。此时细胞中因失去了MPF的活性作用,磷酸化的组蛋白、核纤层蛋白等可在磷酸酶作用下发生去磷酸化,染色体重新开始凝集、核膜也再次组装,子代细胞核逐渐形成。
MPF激酶活性降低,也促进了胞质分裂发生。随着后期MPF的失活,磷酸酶使肌球蛋白去磷酸化而活性恢复,肌球蛋白与肌动蛋白相互作用使收缩环不断缢缩直至细胞质发生分裂。
(三)细胞周期检测点监控细胞周期的运行
细胞周期在正常条件下顺序性地按G1-S-G2-M循环运转,虽然细胞周期进程不可逆,但如果细胞所处环境变化,细胞周期正常事件受到影响或干扰时,为确保细胞周期的正确性,可发生细胞周期的暂停乃至终止。
为防止子细胞出现DNA突变,细胞中存在着一系列复杂的监控系统,可对细胞周期发生的重要事件及出现的故障加以检测,只有当这些事件完成或故障修复后,保证细胞周期的每个关键环节准确完成后才能进入下个环节,该监控系统即为检测点(checkpoint),包括未复制DNA检测点、纺锤体组装检测点、染色体分离检测点及DNA损伤检测点(图13-15)。
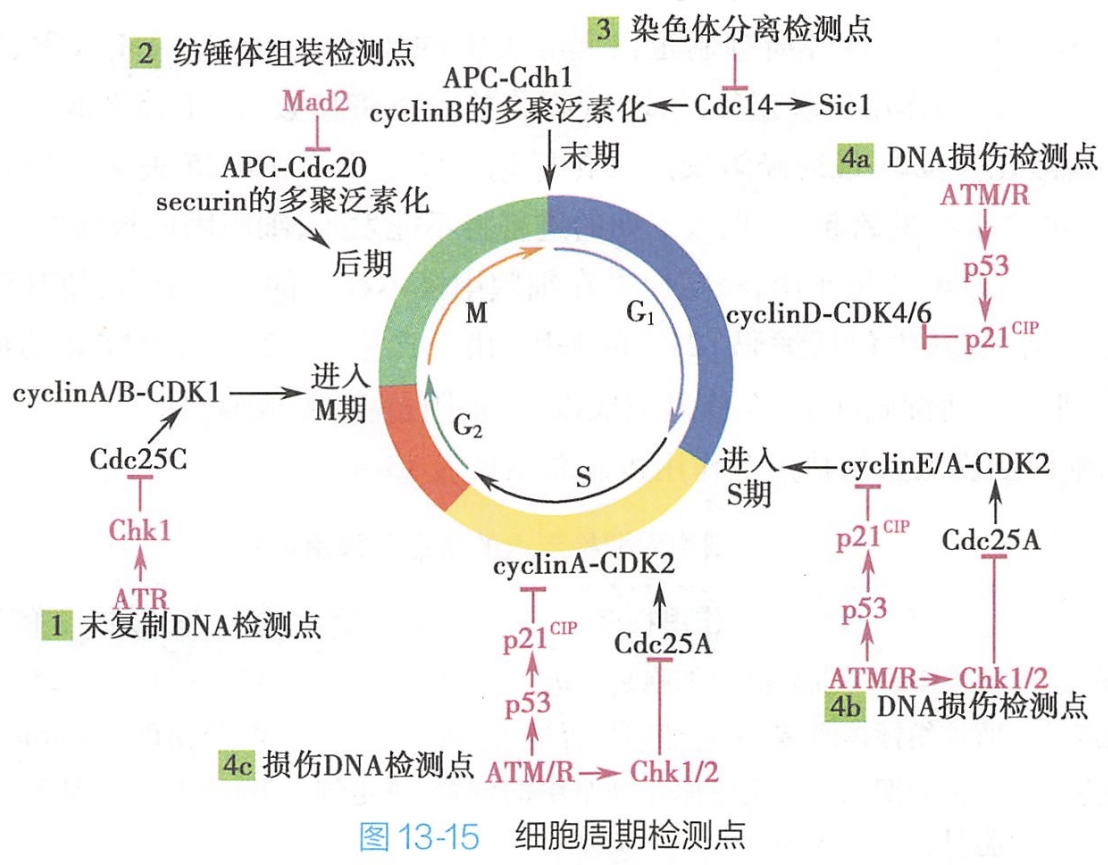
细胞周期检测点又称细胞周期检测系统,本质是由众多蛋白质分子构成的复杂信号转导网络。该系统中感受分子(sensor)一旦捕捉到异常信号,通过转导分子(conductor)实施信号转导,最终由效应分子(effector)直接执行细胞周期负性调控。
细胞周期检测系统首先启动细胞周期阻滞(cell cycle arrest),即细胞周期暂停,细胞将不能从一个阶段转向下一个阶段,进而通过应激启动基因表达,合成特定蛋白质,实施故障修复。例如DNA损伤条件触发细胞周期阻滞时,将动员强大的DNA修复系统实施损伤DNA的修复,当故障排除后,细胞周期阻滞解除,细胞周期开启向下一个阶段的运行;但是,如果错误无法纠正,例如核辐射等导致的严重的DNA双链断裂,细胞周期终止而细胞发生凋亡。

1.未复制DNA检测点
在正常的细胞周期中,DNA未发生复制时,细胞不能进入有丝分裂。未复制DNA检测点的作用主要包括识别未复制DNA并抑制MPF激活。
在裂殖酵母与爪蟾卵细胞提取物中,有两种蛋白激酶在未复制DNA检测点有重要的功能,即ATR与Chk1,它们能阻止未经DNA复制的细胞发生分裂。在DNA复制进行过程中,ATR在与DNA复制叉结合后被激活,由此引起一系列蛋白激酶级联反应,即:ATR磷酸化激活Chk1激酶,Chk1再磷酸化Cdc25磷酸酶,使其不能去除M期Cdk上抑制其活性的磷酸基,cyclinA-Cdk1或cyclinB-Cdk1复合物保持被抑制状态,不能磷酸化启动M期的靶蛋白。
上述活动可持续发生,直至所有复制叉上DNA合成全部完成,复制叉解体,由此使得M期必须在DNA合成结束后才能发生。
2.纺锤体组装检测点
该检测点的作用主要是阻止纺锤体装配不完全或发生错误的中期细胞进入后期,即使细胞中仅有一个染色单体上的动粒未与纺锤体微管正确相连,后期也不能发生。
对酵母纺锤体组装检测,点突变体的研究证实,Mad2是纺锤体组装检测点作用机制中关键的蛋白质。在细胞周期进程中,APC所介导的securin蛋白的多聚泛素化控制着中期向后期的转化,Mad2对APC的激活因子Cdc20有抑制作用。在中期染色体上,若有某一动粒未与纺锤体微管相连接,Mad2将结合于该动粒上并短暂激活,与Cdc20附着使其失活,APC活化及securin蛋白的多聚泛素化受阻,染色单体着丝粒间不能分离,由此阻止了细胞进入后期。
一旦染色体上所有的动粒均被动粒微管附着,纺锤体组装完成,Mad2与动粒的结合停止,恢复其无活性状态,Cdc20活性抑制状态被解除,引起 APC相继活化及securin蛋白的多聚泛素化,启动染色单体的分离及细胞向后期的转化。
3.染色体分离检测点
在细胞周期进程中,末期发生的各种事件及随后的胞质分裂,均需要 MPF的失活。Cdc14磷酸酶的活化,能促使M期cyclin经多聚泛素化途径被降解,导致MPF活性的丧失,引发细胞转向末期。
染色体分离检测点是通过监测发生分离的子代染色体在后期末细胞中的位置,来决定细胞中是否产生活化的Cdc14磷酸酶,以促进细胞进入末期,发生胞质分裂,最后退出M期。该检测点的存在阻止了在子代染色体未正确分离前末期及胞质分裂的发生,保证了子代细胞含有一套完整的染色体。
4.DNA损伤检测点
在细胞周期过程中,DNA可能因外界化学及物理因素的影响而被损伤,此时,DNA损伤检测点将阻止细胞周期继续进行,直到DNA损伤被修复。如果细胞周期被阻在G1或S期,受损的碱基将不能被复制,由此可避免基因组产生突变以及染色体结构的重排。若细胞周期被阻在G2期,可使DNA双链断片得以在细胞进行有丝分裂以前被修复。
在DNA损伤检测点,有三种肿瘤抑制蛋白起着关键的作用,它们是ATM/ATR、Chk1/2及p53。
- 当DNA因紫外线或射线的作用出现损伤时,DNA损伤检测点将被激活,在活化蛋白激酶Chk2后,可使磷酸酶Cdc25磷酸化,Cdc25最终经多聚泛素化标记后发生降解。Cdc25失活将导致Cdk2不能活化,由cyclin E-Cdk2或cyclin A-Cdk2介导的跨越G1期或S期的进程将不能发生,细胞因此被滞留于G1或S期。
- 活化的ATM/ATR也能通过磷酸化作用,稳定原本在细胞中极不稳定的p53蛋白(一种转录因子),使其对某些特异性基因转录的促进能力增强,其中包括编码p21cip的基因,由此产生的p21cip可将哺乳动物所有的cyclin-Cdk的活性抑制,进一步使细胞在DNA修复完成以前,被阻留在G1或G2期。
以上四种细胞周期检测点的特点及作用机制总结见表13-4。
(四)多种因素与细胞周期调控密切相关
1.生长因子
生长因子(growth factor)是一类由细胞自分泌或旁分泌产生的多肽类物质,在与细胞膜上特异性受体结合后,经信号转换及多级传递,可激活细胞内多种蛋白激酶,促进或抑制细胞周期进程相关的蛋白质表达,由此可参与对细胞周期的调控。(应该是细胞因子的一种)
生长因子的作用为细胞周期正常进程所必需。处于G1早期的细胞,若缺乏生长因子的刺激,将不能向S期转换,进而脱离细胞周期,进入静止状态,成为G0期细胞。细胞周期被细胞外信号调控的例子是生长因子对动物细胞增殖的效应。
此外,在细胞周期进程中,细胞周期的不同阶段,例如细胞生长、DNA复制和有丝分裂必须是协同的。
能影响细胞增殖及调控细胞周期的生长因子有多种,常见的如:表皮生长因子(epidermal growth factor,EGF)、血小板衍生生长因子(platelet-derived growth factor,PDGF)、转化生长因子(transforming growth factor,TGF)、白介素(interleukin,IL)等,这些因子对细胞周期的主要作用阶段均在G1期与S期,可刺激或抑制静止期细胞进入G1期或S期。不同的因子在调控的具体时段上存在差异:
- PDGF的调节点一般在G1期以前的G0向G1期转变过程中。
- EGF、IL、TGF-α、TGF-β的调节点则在G1期向S期转换过程中。
一种细胞的细胞周期可受到多种生长因子的调控,而同一种生长因子又可作用于多种类型细胞的增殖过程,并随细胞类型的不同,作用效应也表现出差异。如TGF-B对细胞增殖是促进还是抑制,取决于所作用的细胞类型,就大多数类型细胞而言,TGF-β在细胞周期中具有抑制细胞分裂的作用,而对少数间质来源的细胞,如成骨细胞,TGF-β却表现为促进细胞分裂。
生长因子对细胞周期的调控效应还与生长因子浓度及其与受体的亲和性相关,当生长因子浓度升高或与受体亲和性增强,对细胞周期的调控作用将得到促进。
2.抑素
抑素(chalone)是一种由细胞自身分泌的,能抑制细胞周期进程的糖蛋白,通常分布于其发挥作用的特异性组织中。抑素主要在G1期末及G2期对细胞周期产生调节作用:
- 在G1期发挥作用的抑素通常被称为S因子,能阻制G1期细胞进入S期。
- 在G2期起作用的抑素又称为M因子,能抑制G2期细胞向M期的转变。
抑素可通过与细胞膜上特异性受体结合,引起信号的转换及向胞内的传递,进而对细胞周期相关蛋白的表达产生影响,这种调控方式与生长因子的作用极其类似。抑素对细胞周期的作用具有无毒及可逆的特点,并表现出较强的细胞系特异性,可随细胞类型不同而有所差异,如红细胞、淋巴细胞、肝细胞、表皮细胞等均存在其特异性的抑素。
3.胞内信使
cGMP能促进细胞分裂中DNA及组蛋白的合成,cAMP对细胞分裂有负调控作用,其含量降低时,细胞DNA合成及细胞分裂将加速。cGMP浓度升高常发生于一些恶性肿瘤的细胞中。
4.RNA剪接因子
真核细胞基因在表达为蛋白质前,均需经历一个RNA剪接的过程。两种影响RNA剪接的因子,即剪接因子SR蛋白与SR特异激酶(SR protein-specific kinase,SRPK1),已被证实与细胞周期调控相关。